专家简历

林彩玲 教授
福建省立医院乳腺外科 副主任医师
福建省癌症康复协会第一届专家委员会常务委员
福建省海峡肿瘤防治科技交流协会乳腺肿瘤防治分会常务委员
福建省基层卫生协会乳腺疾病防治专业委员会常务委员
中国抗癌协会中西整合乳腺癌专业委员会委员
中国医药教育协会肿瘤精准诊疗专业委员会委员
福建省医师协会普通外科医师分会青年委员
中国微循环学会肿瘤专业委员会委员
福建省健康管理师协会乳腺健康管理专业委员会委员
福建省海峡肿瘤防治科技交流协会妇科与乳腺肿瘤防治专业委员会委员
福建省海峡医药卫生交流协会乳腺肿瘤微无创分会理事
参与主持多项省级及厅级课题,发表多篇SCI及核心期刊论文
长期从事乳腺恶性肿瘤的诊断及综合治疗,精于乳腺癌的保乳术、改良根治术、乳房重建术,擅长乳腺癌新辅助治疗、术后辅助治疗及晚期乳腺癌的综合治疗及个体化精准治疗;乳腺良性肿瘤的微创手术、乳腺炎的个体化治疗,男性乳房发育症的手术治疗。

前言
乳腺癌是女性常见的恶性肿瘤,骨骼是乳腺癌最常见的远处转移部位,约占所有转移性乳腺癌患者的70%1,2。骨转移灶形成的软组织包块可对周围重要神经血管形成压迫,导致肢体局部功能丧失,骨痛、病理性骨折、脊髓压迫及高钙血症等骨相关事件(SREs)的出现,严重影响患者的自主活动能力及生存质量3。为早期识别乳腺癌骨转移、控制骨转移灶进展并对骨转移灶及时进行干预,从而改善患者的生存质量,CCMTV特邀福建省立医院乳腺外科林彩玲教授,结合临床证据与实践经验,系统阐述乳腺癌骨转移的早期诊断路径及全程管理策略,为临床决策提供科学参考。
CCMTV临床频道:骨骼是乳腺癌最常见的远处转移部位。能否请您谈谈对于早期骨转移的识别,患者需要关注哪些具有提示意义的临床信号?
林彩玲教授:乳腺癌骨转移在临床上多表现为单发或多发的溶骨性病变4,少数患者表现为溶骨成骨混合性病变。骨转移灶破坏骨的生理结构与机械强度,常伴有中重度骨痛,严重者可发展为病理性骨折。骨转移灶形成的软组织包块可对周围重要神经血管形成压迫,导致肢体局部功能丧失。骨痛、病理性骨折、脊髓压迫及高钙血症等SREs的出现,严重影响患者的自主活动能力及生存质量。
乳腺癌骨转移的早期可能并无症状,常通过常规随访被发现。当出现症状时,识别其特点至关重要。骨痛是最常见、最典型的症状,通常表现为持续性钝痛或隐痛,夜间可能加重,休息后难以缓解,位置固定于骨骼区域(如脊柱、骨盆、肋骨、长骨)。若患者出现活动后突发剧烈疼痛,需高度警惕病理性骨折,这是骨转移导致骨结构破坏、力学强度下降的严重后果,椎体与股骨是好发部位。
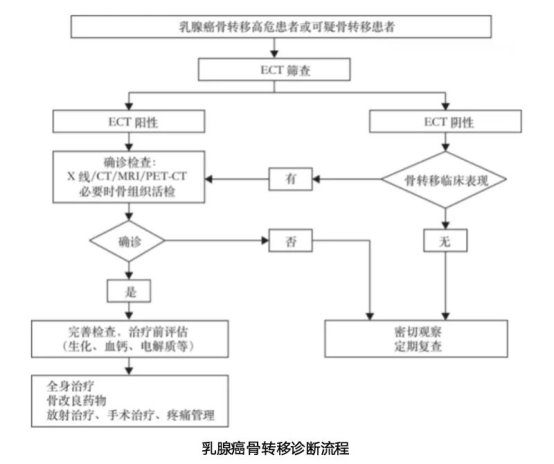
此外,当转移灶位于脊椎时,肿瘤或骨折碎片可能压迫脊髓,引发一系列神经功能缺损的紧急症状,包括受累平面以下的进行性肢体麻木、无力、感觉减退,严重时可导致瘫痪和大小便失禁,此为肿瘤科急症,需立即干预5。另一隐匿但危险的信号是高钙血症,源于骨骼破坏释放大量钙质入血,可引起疲劳、恶心、呕吐、便秘、多尿、脱水,甚至意识模糊和昏迷。此外,不明原因的碱性磷酸酶、乳酸脱氢酶水平升高,或肿瘤标志物(如CEA、CA153)异常升高,都可能提示存在骨转移风险6。因此,对乳腺癌患者新出现的任何持续性骨痛或上述全身症状,都应给予充分重视,及时行骨放射性核素扫描(ECT)等检查。
CCMTV临床频道:基于乳腺癌骨转移的复杂性,目前临床上有哪些科学、有效的早期筛查和诊断方法?
林彩玲教授:乳腺癌骨转移的早期筛查与诊断是一个系统性的过程,需要结合影像学、病理学及分子生物学等多种手段进行综合判断7。
影像学检查是诊断骨转移的核心手段,各种方法各有优势,需根据临床情况选择与结合:
1)ECT:为骨转移筛查的最常用方法。具有敏感性高、全身显像不易漏诊的优点,但同时也存在特异性较低,不能显示骨破坏程度等问题,需与其他检查联合使用。常推荐用于出现骨痛、病理性骨折、碱性磷酸酶升高或高钙血症等可疑骨转移的乳腺癌患者的筛查,以及诊断为乳腺癌骨转移患者的常规复查手段。对于骨放射性核素显像提示异常的乳腺癌患者,应进一步针对可疑部位进行X线、CT或MRI检查,以明确病变性质。
2)X线:通过对ECT识别的重点区域行X线检查,可以明确病变具体位置和与周围骨与关节的关系。X线检查特异性较高,但敏感性较低,难以发现早期转移灶。乳腺癌骨转移在X线上常表现为溶骨性破坏,但也可见成骨性或混合性病变。通过X线检查可识别骨破坏性质,发现病理性骨折,以及评估病灶发生病理性骨折的风险等。
3)CT:较X线的敏感性和特异性均更高。对病变部位进行CT检查可以进一步明确病变和相邻组织关系,对判断皮质骨破坏范围及程度较有帮助,尤其适用于复杂解剖部位的转移灶。增强CT扫描可用于判断病变血供情况,并显示病变与周围神经、血管结构的关系,为外科治疗提供帮助。
4)MRI:对诊断乳腺癌骨转移的敏感性更高,能更准确地显示病灶侵犯部位、范围及周围软组织侵犯情况,明确病变与周围软组织和重要神经血管关系,是评价乳腺癌骨转移骨髓内浸润的首选工具。同时对于位于脊柱的转移性病灶,MRI在判断病变范围,脊髓及神经受累及情况具有突出优势。
5)PET-CT:可以在临床早期发现骨转移的异常信号,灵敏度和特异度都很高,对乳腺癌骨转移治疗后病情的跟踪优于骨扫描,但在显示骨质结构变化方面不如X线或CT骨窗图像直观,需要在PET/CT报告的CT部分提供骨窗图像明确是溶骨还是成骨转移,才能在治疗中随访评价骨转移骨质部分的疗效变化。
病理学检查是确诊乳腺癌骨转移的金标准。如果临床上可行,应积极对可疑骨病灶进行组织学检查以明确诊断,尤其是首次出现的可疑转移灶和单发骨病灶。如组织病理学确诊为乳腺癌骨转移,应同时对转移灶的分子分型进行判断。尤其在治疗反应不符合原发灶肿瘤分子分型特点,及原发病灶分子分型不明确的患者中更为重要。
分子生物学评估为乳腺癌骨转移的诊疗提供了重要的动态监测信息。骨代谢的生物化学标志物可反映骨转移过程中骨吸收和形成的速度,提示骨破坏和修复程度,是评价治疗反应的辅助指标。主要有反映溶骨代谢水平的标志物,如Ⅰ型胶原C末端肽(β-CTx)、Ⅰ型胶原羧基末端肽(ICTP)、Ⅰ型胶原N末端肽(NTX)等;另一方面是反映成骨性代谢水平的标志物,主要有骨特异性碱性磷酸酶(BALP)、总碱性磷酸酶(ALP)、Ⅰ型原胶原N端前肽(PINP)等8。
CCMTV临床频道:一旦通过骨扫描、CT或MRI等影像学检查确诊骨转移,应如何进行病理性骨折、脊髓压迫、高钙血症等SREs的预防?
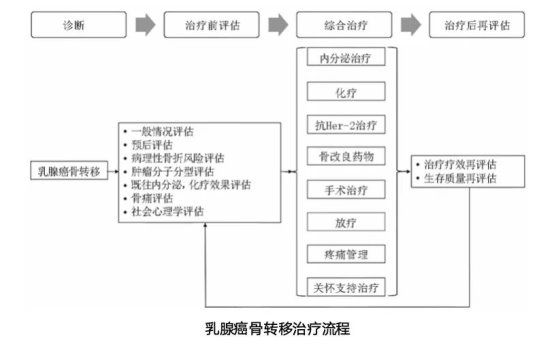
林彩玲教授:一旦确诊乳腺癌骨转移,核心干预方向是尽早启动骨保护治疗,从“被动应对并发症”转向“主动预防SREs”。结合《乳腺癌骨转移临床诊疗专家共识》4及临床实践,需通过“全身治疗+局部管理+综合防护”的系统性策略,降低病理性骨折、脊髓压迫、高钙血症等SREs的发生风险,同时维护患者生存质量。从治疗原则来看,乳腺癌骨转移作为全身性疾病,需以化疗、内分泌治疗或靶向治疗等全身方案为基础,同时结合手术或放疗等局部手段,对承重骨转移灶或脊髓压迫高危病灶进行提前干预,避免在骨折、截瘫等严重并发症发生后再被动治疗。
有效控制系统性病灶是预防SREs的治本之策。临床需依据肿瘤的分子分型、既往治疗史及肿瘤负荷,制定个体化方案:对于HR+/HER2-的患者,优先推荐内分泌治疗;对于HER2+患者,应联合抗HER2靶向治疗;而对于疾病进展迅速、三阴性或出现耐药的患者,则可考虑化疗。通过有效抑制全身肿瘤细胞的活性,能从源头上减缓骨转移灶的进展与骨破坏的加剧。
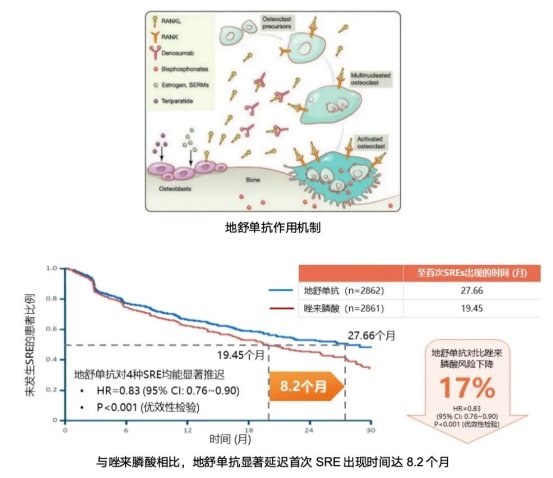
无论患者是否已出现骨骼症状,确诊骨转移后即应尽早启动骨改良药物治疗。目前临床主要应用地舒单抗和双膦酸盐类药物,机制各有不同。地舒单抗是一种全人源单克隆抗体,其核心作用机制为以高特异性、高亲和力结合RANKL,从而精准阻断RANKL与RANK的结合。RANKL/RANK信号通路是破骨细胞分化、激活的关键信号途径,地舒单抗通过抑制该通路,可有效抑制破骨细胞的形成、功能和存活,达到保护骨骼、延缓SREs的目的。而双膦酸盐类药物则主要通过与骨基质中羟基磷灰石的高亲和力结合,进而抑制骨吸收过程。其作用机制包括:抑制破骨细胞成熟并诱导其凋亡、促进肿瘤细胞凋亡抑制其生长,以及调节免疫微环境。在疗效方面,一项纳入5723例实体瘤(包括乳腺癌)骨转移患者的荟萃分析显示,与唑来膦酸相比,地舒单抗能显著延迟首次SRE的发生时间达8.2个月(27.66个月 vs 19.45个月),并降低17%的SRE发生风险(HR=0.83)9。此外,地舒单抗不经肾脏代谢,对于合并肾功能不全的患者无需调整剂量,在特殊人群应用中更具便利性与安全性。
对于存在明确结构性破坏或神经压迫高风险的患者,及时的局部干预至关重要。放射治疗是缓解局部骨痛、预防和治疗脊髓压迫等神经系统并发症的有效方法,并可对术后进展病灶进行局部控制,巩固全身治疗效果。外科手术的价值在于处理或预防即将发生或已发生的病理性骨折,以及解除脊髓压迫。关键在于把握手术时机,争取在发生不可逆的神经功能损伤或骨折前进行干预,以最大程度恢复或保留运动系统功能,缓解疼痛。
生活方式的科学调整与定期监测同样不可或缺。确保每日充足的钙与维生素D摄入是维持骨矿物质平衡、支持骨改良药物疗效的营养基础。在身体条件允许下,进行适度的、在专业指导下的运动,有助于维持骨密度与肌肉力量,但需严格避免剧烈活动与突然发力,以防意外骨折。患者需遵医嘱定期进行影像学复查,以客观评估骨转移灶的稳定性与骨质结构变化。同时,血液学监测(如血钙、碱性磷酸酶及骨代谢标志物等)有助于早期发现高钙血症和监测骨代谢动态,为治疗调整提供依据。
针对特殊并发症的预防措施更需贯穿全程。药物相关下颌骨坏死虽罕见但严重,建议治疗前完成口腔检查,治疗期间维持良好口腔卫生,并尽量避免复杂的侵入性牙科手术,以显著降低其发生风险。对于股骨等承重骨存在明确溶骨性破坏的患者,在医生评估后使用适当的外部支具,可为骨骼提供额外力学支撑,是降低病理性骨折风险的有效物理措施。
综上,预防乳腺癌骨转移相关SREs是一项贯穿始终的系统工程,需要以规范的全身抗肿瘤治疗为根本,以早期、规律应用骨改良药物为核心,并联合必要的局部治疗、全面的支持性护理和持续的监测评估,共同构建一个多学科协作的主动管理策略。
总结
乳腺癌骨转移的防治需构建“早期识别-精准评估-主动干预”的全程管理体系。影像学与病理学评估的联合应用是早期诊断的核心,而以骨改良药物为基础、全身抗肿瘤治疗联合局部干预的综合策略,是降低SREs风险的关键。随着肿瘤诊疗技术的进步,骨转移管理已从“并发症治疗”转向“全程风险防控”,未来需进一步依托分子标志物监测与精准影像技术,推动骨转移防治的规范化与个体化发展,最终通过科学的全程管理策略实现患者长期生存获益。


参考文献
Harbeck N, Penault-Llorca F, Cortes J, et al.Nat Rev Dis Primers, 2019, 5(1): 66.
-
Weilbaecher KN, Guise TA, McCauley LK.Nat Rev Cancer, 2011, 11(6): 411-425.
-
Coleman RE.Clin Cancer Res, 2006, 12(20 Pt 2): 6243s-6249s.
-
中国抗癌协会骨肿瘤和骨转移瘤专业委员会.中国肿瘤临床, 2022, 49(13): 660-669.
-
杨勇, 姜玉秋, 王永高, 等.中国普外基础与临床杂志, 2016, 23(02): 253-257.
-
Duan J, Fang W, Xu H, et al.J Natl Cancer Cent., 2023, 3(4): 256-265.
-
《中国临床肿瘤学会乳腺癌诊疗指南2025》
-
Zulauf N, et al.Oncology, 2019; 97(4): 236-244.
-
Lipton A, Fizazi K, Stopeck AT, et al.Eur J Cancer, 2012; 48: 3082-3092
标题:林彩玲教授:乳腺癌骨转移早期诊断与SREs预防策略
地址:http://www.yqjqqwc.cn/ydxw/51099.html



